燎原双语学校第一学期期中考试
高 ____________________年级 ____________________学科 试题
满分分值:
100 分 完卷时间:______________________________分钟
相对原子水平:H-1,C-12,O-16,Na-23, Mg-24,Al-27,S—32,Fe—56,Ca- 40,Cl-35.5
一.选择题(每小题只有一个正确答案,每小题 2 分,共 40 分 ) 1.下列物质的分子为极性分子的是
A.C2H2 B. CO2 C. NH3 D. BF3
2.下列现象中,可以用范德华力讲解的是
A. 氮气的化学性质稳定 B. 一般情况下,溴呈液态,碘呈固态 C. 氢氧化钠的熔点高于氢氧化钾 D. 锂的熔点比钠高
3.对碳原子核外两个未成对电子的描述,正确的是
A.电子云形状不同 B.自旋方向相同 C.能量不同 D.在同一轨道 4.下列分子中,是含有极性键的非极性分子的是
A.H2O B.Br2 C.CH4 D.HCl 5.有关氮原子核外 p 亚层中的电子的说法错误的是
A.能量相同 B.电子云形状相同
C.自旋方向相同 D.电子云伸展方向相同 6.有关化学键和晶体的叙述中正确的是
A.分子晶体中,分子间用途力越大分子越稳定
B.分子晶体都是由共价分子构成的
C.离子晶体中可能含有共价键
D.原子晶体中只存在非极性键.
![]() 7.在肯定温度下反应:A2(气)+B2(气) 2AB(气)达平衡状况的标志是 A.单位时间内生成 n 摩 A2,同时生成 n 摩 AB
7.在肯定温度下反应:A2(气)+B2(气) 2AB(气)达平衡状况的标志是 A.单位时间内生成 n 摩 A2,同时生成 n 摩 AB
B.单位时间内生成 n 摩 B2,同时生成 2n 摩 AB
C.单位时间内生成 n 摩 A2,同时生成 n 摩 B2
D.容器内总物质的量不变(或总压不变)
8.甲烷与四氯化碳分子的空间构型相同,有关两者的比较中正确的是
A.甲烷与四氯化碳分子都是含有极性键的极性分子
B.甲烷与四氯化碳分子内的键角均为 600
C.甲烷沸点低于四氯化碳,由于 C—H 键键长比 C—Cl 键短
D.甲烷分子比四氯化碳稳定,由于 C—H 键键能比 C—Cl 键大
9.Na2O2、CaC2 都是离子化合物,都能与水反应放出气体。它们
A.阴阳离子个数比均为 1:1 B.都含有非极性的共价键
![]() C.与水都发生氧化还原反应 D.放出的都是可燃性气体 10.在 2A+B 3C+4D 反应中,表示该反应速率最快的是
C.与水都发生氧化还原反应 D.放出的都是可燃性气体 10.在 2A+B 3C+4D 反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s) 11.下列叙述正确的是
A.CaCO3 在水中溶解度非常小,其水溶液电阻非常大,所以 CaCO3 是弱电解质
B.CaCO3 在水中溶解度非常小,但溶于水的 CaCO3 全部电离,所以 CaCO3 是强电解质 C.氯气和氨气的水溶液导电性好,所以它们是强电解质
![]() D.液态 SO2 不导电,但溶于水后导电,所以 SO2 是电解质
D.液态 SO2 不导电,但溶于水后导电,所以 SO2 是电解质
12.肯定条件下反应 2AB A2+B2达到平衡状况的标志是
A.单位时间内生成 nmolA2,同时消耗 2n molAB
B.容器内,3 种气体 AB、A2、B2 共存
C.AB 的消耗速率等于 A2 的消耗速率
D.容器中各组分的体积分数不随时间变化
13.ICl 能发生下列变化,其中变化时会破坏化学键的是
![]() A.升华 B.熔化 C.溶于 CCl4 D.受热分解
A.升华 B.熔化 C.溶于 CCl4 D.受热分解
14.在容积不变的密闭容器中进行如下反应:N2+3H2 2NH3,若将平衡体系中
各物质的浓度都增加到原来的 2 倍,则产生的结果是
⑴ 平衡不发生移动 ⑵ 平衡沿着正反应方向移动
⑶ 平衡沿着逆反应方向移动 ⑷ NH3 的水平分数增加
⑸ 正逆反应速率都增大
A.(1)(5) B.(1)(2)(5) C.(3)(5) D.(2)(4)
(5)
![]() 15.在肯定温度不同压强(P1<P2)下,可逆反应 2X 2Y + Z 中,生成物 Z 在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以 下图示,正确的是
15.在肯定温度不同压强(P1<P2)下,可逆反应 2X 2Y + Z 中,生成物 Z 在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以 下图示,正确的是

16.晶体的叙述中,正确的是
A.原子晶体中,共价键的键能越大,熔、沸点越高 B.分子晶体中,分子间有哪些用途力越大,该分子越稳定 C.分子晶体中,共价键的键能越大,熔、沸点越高 D.离子晶体未必能溶于水,但肯定不含非极性共价键
![]() 17.在一密闭容器中,反应 aA(气) bB(气)达平衡后,维持温度不 变,将容器体积增加一倍,当达到新的平衡时,B 的浓度是原来的 60%,则 A.平衡向正反应方向移动了 B.物质 A 的实际转化的比例降低了
17.在一密闭容器中,反应 aA(气) bB(气)达平衡后,维持温度不 变,将容器体积增加一倍,当达到新的平衡时,B 的浓度是原来的 60%,则 A.平衡向正反应方向移动了 B.物质 A 的实际转化的比例降低了
C.物质 A 的水平分数增加了 D.a>b
18.近期有科学家成功地在高压下将 CO2 转化具备类似 SiO2 结构的原子晶体,下
列关于 CO2 的原子晶体说法正确的是
A.在肯定条件下,CO2 原子晶体转化为分子晶体是物理变化 B.CO2 的原子晶体和 CO2 分子晶体具备相同的物理性质和化学性质
C.在 CO2 的原子晶体中,每一个 C 原子周围结合 4 个 O 原子,每一个 O 原子跟两个 C 原子相结合
D.CO2 的原子晶体和分子晶体组成相同,事实上是同一种物质
19.有四组同一族元素所形成的不同物质,在 101kPa 时测定它们的沸点(℃)
如下表所示:
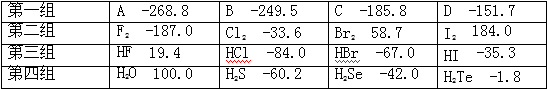
![]() 下列各项判断正确的是
下列各项判断正确的是
A.第四组物质中 H2O 的沸点最高,是由于 H2O 分子中化学键键能最强
B.第三组与第四组相比较,化合物的稳定性顺序为:HBr>H2Se
C.第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI
D.第一组物质是分子晶体,肯定含有共价键
![]() 20.下图表示反应 N2(g)+3H2(g) 2NH3(g)+92.2kJ。
20.下图表示反应 N2(g)+3H2(g) 2NH3(g)+92.2kJ。
在某段时间 t0~t6 中反应速率与反应过程的曲线图,则氨的百分含量最高 的一段时间是
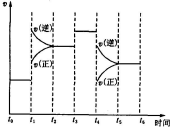
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
二.填空题
21.有下列七种晶体:A.二氧化硅 B.冰醋酸 C.白磷 D.固体氬 E.氯化铵 F.铝 G.金刚石
用序号回答下列问题:
⑴是原子晶体的化合物是__________,由单一原子构成的高熔点的晶体是
____________________,直接由原子构成的分子晶体是__________。
⑵由极性分子构成的晶体__________,含有共价键的离子晶体是__________,是分子 晶体的单质是__________。
⑶在肯定条件下能导电而不发生化学反应的是__________,分子内存在化学键,但 受热融化时化学键不发生变化的是__________,受热融化需克服共价键的是____________________
____________________。
22.现已合成一种比金刚石硬度还大的晶体——氮化碳,已知氮在化合物中呈-3
价,判断它的化学式可能是__________,其晶体种类为__________,你觉得其硬度比 金刚石大是什么原因______________________________
23.下列中所列的是五种短期周期元素原子的半径及主要化合价:
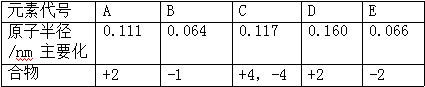
⑴C 元素在周期表中的地方__________;E 原子的电子填充在__________个
轨道上,这类电子有__________种不一样的能量。
⑵B、D、E 所代表元素的离子半径从大到小的顺序为__________
⑶C 与 E 形成的化合物是__________晶体。
⑷已知 X 是与 E 同族的另一短周期元素,有人觉得:H-E 键的键能大于 H-X 键 的键能,所以 H2E 的沸点高于 H2X 的沸点。你是不是同意这种看法__________,理由:__________。
![]() 24.H2 和 CO 合成甲醇反应为:CO(g)+2H2(g) CH3OH(g)(正反应是放热
24.H2 和 CO 合成甲醇反应为:CO(g)+2H2(g) CH3OH(g)(正反应是放热
反应)。在恒温,体积为 2L 的密闭容器中分别充入 1.2mol CO 和 1mol H2, 10min 后达到平衡,测得含有 0.4mol CH3OH(g)。则达到平衡时 CO 的浓度 为__________;10min 内用 H2 表示的化学反应速率为__________;若要加快 CH3OH 的生成速率并提升 CO 的实际转化的比例,可采取的手段有____________________(填一种合 理的手段)。
![]() 25.工业上烟气脱氮的原理 NO + NO2 + 2NH3 2N2 + 3H2O+Q
25.工业上烟气脱氮的原理 NO + NO2 + 2NH3 2N2 + 3H2O+Q
⑴ 该反应化学平衡常数 K 的表达式为__________。
假如平衡常数 K 值增大,对__________的速率影响 更大。
⑵若反应在恒容条件下进行,能说明反应已经达到平衡状况的是__________ a.容器内混合物的水平不变 b.容器内气体的压强不变 c.反应消耗 0.5mol NO 的同时生成 1mol N2 d.NO2 的浓度不变
 ⑶向 2 L 密闭容器中加入反应物,10 min 后达到平衡,测
⑶向 2 L 密闭容器中加入反应物,10 min 后达到平衡,测
得平衡时氮气物质的量增加了 0.2mol,则用 H2O表示 的平均反应速率为__________。
⑷如图是 P1 压强下 NO 的实际转化的比例随反应时间的变化图, 请在图中画出其他条件不变状况下,压强为 P2 下 NO 的实际转化的比例随反应时间变化的示意图。
⑸写出反应物中的氨气的电子式__________;其空间构型为______;它常用来生产 化肥 NH4Cl。NH4Cl 溶液显__________性;
常温下将等体积等浓度的氨水和 NH4Cl 溶液混合,pH>7,溶液中 NH3·H2O、H
![]() +、OH-、NH +、Cl 一浓度由大到小的关系是____________________
+、OH-、NH +、Cl 一浓度由大到小的关系是____________________
__________。
26.氯元素在自然界有 35Cl 和 37Cl 两种同位素,氯元素的相对原子水平为 35.5 其两者的原子个数比为__________;由 Na、35Cl 和 37Cl 构成的 11.7g 氯化 钠晶体中含 35Cl 的水平是__________g;11.7g 该晶体刚好能和某 200mL 的 AgNO3 溶液完全反应,则该 AgNO3 溶液的物质的量浓度是__________mol/L。
燎原双语学校 2018 学年第一学期期中考试
高______________________________年级______________________________学科 答卷试题
一.单项选择题(共 40 分,每小题只有一个是正确的)
二.填空题
21.有下列七种晶体:A.二氧化硅 B.冰醋酸 C.白磷 D.固体氬 E.氯化铵 F.铝 G.金刚石
用序号回答下列问题:
⑴是原子晶体的化合物是__________,由单一原子构成的高熔点的晶体是
____________________,直接由原子构成的分子晶体是__________。
⑵由极性分子构成的晶体__________,含有共价键的离子晶体是__________,是分子 晶体的单质是__________。
⑶在肯定条件下能导电而不发生化学反应的是__________,分子内存在化学键,但 受热融化时化学键不发生变化的是__________,受热融化需克服共价键的是
____________________。 22.现已合成一种比金刚石硬度还大的晶体——氮化碳,已知氮在化合物中呈-3
价,判断它的化学式可能是__________,其晶体种类为__________,你觉得其硬度比 金刚石大是什么原因______________________________
23.下列中所列的是五种短期周期元素原子的半径及主要化合价:

⑴C 元素在周期表中的地方__________;E 原子的电子填充在__________个
轨道上,这类电子有__________种不一样的能量。
⑵B、D、E 所代表元素的离子半径从大到小的顺序为__________
⑶C 与 E 形成的化合物是__________晶体。
⑷已知 X 是与 E 同族的另一短周期元素,有人觉得:H-E 键的键能大于 H-X 键 的键能,所以 H2E 的沸点高于 H2X 的沸点。你是不是同意这种看法__________,理由:__________。
![]() 24.H2 和 CO 合成甲醇反应为:CO(g)+2H2(g) CH3OH(g)(正反应是放热
24.H2 和 CO 合成甲醇反应为:CO(g)+2H2(g) CH3OH(g)(正反应是放热
反应)。在恒温,体积为 2L 的密闭容器中分别充入 1.2mol CO 和 1mol H2, 10min 后达到平衡,测得含有 0.4mol CH3OH(g)。则达到平衡时 CO 的浓度 为__________;10min 内用 H2 表示的化学反应速率为__________;若要加快 CH3OH 的生成速率并提升 CO 的实际转化的比例,可采取的手段有____________________(填一种合 理的手段)。
![]() 25.工业上烟气脱氮的原理 NO + NO2 + 2NH3 2N2 + 3H2O+Q
25.工业上烟气脱氮的原理 NO + NO2 + 2NH3 2N2 + 3H2O+Q
⑴ 该反应化学平衡常数 K 的表达式为__________。
假如平衡常数 K 值增大,对__________的速率影响 更大。
⑵若反应在恒容条件下进行,能说明反应已经达到平衡状况的是__________ a.容器内混合物的水平不变 b.容器内气体的压强不变 c.反应消耗 0.5mol NO 的同时生成 1mol N2 d.NO2 的浓度不变
 ⑶向 2 L 密闭容器中加入反应物,10 min 后达到平衡,测 得平衡时氮气物质的量增加了 0.2mol,则用 H2O表示
⑶向 2 L 密闭容器中加入反应物,10 min 后达到平衡,测 得平衡时氮气物质的量增加了 0.2mol,则用 H2O表示
的平均反应速率为__________。
⑷如图是 P1 压强下 NO 的实际转化的比例随反应时间的变化图, 请在图中画出其他条件不变状况下,压强为 P2 下 NO 的实际转化的比例随反应时间变化的示意图。
⑸写出反应物中的氨气的电子式__________;其空间构型为______;它常用来生产 化肥 NH4Cl。NH4Cl 溶液显__________性;
![]()
![]() 常温下将等体积等浓度氨水和 NH Cl 溶液混合,pH>7,溶液中 NH ·H O、H+、 OH-、NH +、Cl 一浓度由大到小的关系是________________________________
常温下将等体积等浓度氨水和 NH Cl 溶液混合,pH>7,溶液中 NH ·H O、H+、 OH-、NH +、Cl 一浓度由大到小的关系是________________________________
_。
26.氯元素在自然界有 35Cl 和 37Cl 两种同位素,氯元素的相对原子水平为 35.5 其两者的原子个数比为__________;由 Na、35Cl 和 37Cl 构成的 11.7g 氯化 钠晶体中含 35Cl 的水平是____________________g;11.7g 该晶体刚好能和某 200mL 的 AgNO3 溶液完全反应,则该 AgNO3 溶液的物质的量浓度是__________mol/L。







